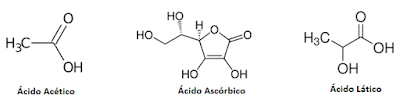
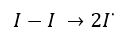PRODUTOS FARMACÊUTICOS E COSMÉTICOS

Devido as suas propriedades (cor, odor, textura), os lipídios apresentam uma grande importância para os produtos cosméticos e farmacêuticos, sendo responsáveis por suas qualidades. É importante ressaltar que também é uma fonte de energia, de ácidos graxos (como ácido linoleico) e de vitaminas lipossolúveis (D,E,K,A). Quando os lipídios são oxidados e tem-se impacto direto no valor comercial dos cosméticos e produtos farmacêuticos. Um grande problema é que a oxidação lipídica é um fenômeno inevitável e espontâneo. Com o passar do tempo, a peroxidação lipídica contribui para modificações de características do produto como, cor, gosto.
As características do produto são fatores importantes para aceitação do consumidor, por isso é de extrema importância a proteção da oxidação lipídica para maior duração do produto, sabendo que o produto tem um prazo de validade.
RADICAIS LIVRES E OS PRINCIPAIS
ANTIOXIDANTES DA DIETA
Radicais Livres:
- Muito instáveis e altamente reagentes.
- Podem se formar no corpo a partir de processos metabólicos normais ou por fontes externas.
Antioxidantes:
- São agentes responsáveis pela proteção do organismo contra ação oxidativa dos radicais, ou seja, inibe e reduz as lesões causadas por radicais livres nas células.
- "Podem ser encontrados naturalmente em nosso organismo e em alimentos. Estes são responsáveis pela proteção do organismo contra a ação oxidativa dos radicais livres". (Halliwell & Guitteridge, 2000)
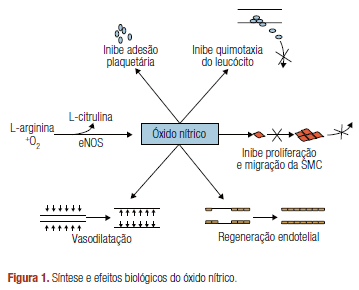
O estresse oxidativo é o desequilíbrio entre a quantidade de oxidantes e radicais livres no corpo, desencadeando uma série de processos que podem gerar prejuízos ao organismo. A ingestão de alimentos com grandes quantidades de antioxidantes, é uma ótima maneira de combater esse desequilíbrio.
Uma curiosidade encontrada em artigos foi que houve comprovação que durante estudos que a prática de exercícios físicos aumentam a quantidade de radicais livres no corpo, devido à maior utilização do oxigênio. Será que não devemos mais praticar exercícios físicos? A resposta é não. Pois, os resultados mostraram que, embora os exercícios físicos aumentem a produção de radicais livres, eles também melhoram a resposta do corpo aos antioxidantes, isso faz com que se mantenha o equílibrio evitando os danos causados pelos radicais livres ao corpo.Porém, não é ideal praticar exercícios físicos entre uma e duas vezes por semana, pois ocorre o excesso de radicais livres continuando o desequilíbrio no corpo.
Os antioxidantes podem ser classificados em: Enzimáticos e Não-Enzimáticos
Sistema Enzimático
O sistema enzimático é o primeiro a acontecer, fazendo com que diminua o excesso de ânion radical superóxido e do peróxido de hidrogênio. O sistema enzimático é formado por várias enzimas, principalmente as enzimas, superóxido dismutase (SOD), a catalase (CAT) e a glutationa peroxidase (GPx).
Responsável pela catalização da dismutação, do superóxido em oxigênio e peróxido de hidrogênio, a enzima superóxido dismutase tem período de meia vida por volta de 10 minutos e não entra nas células. Com isso, esta enzima atua como uma importante mecanismo de defesa antioxidante para várias células que entram em contato com o oxigênio. Pode ocorrer de diferentes formas, dependendo do metal que está ligado a ela. Por exemplo o cobre (Cu):
A Superóxido dismutase é utilizada em produtos cosméticos para reduzir o dano dos radicais livres na pele.
O peróxido de hidrogênio é transformado em água e oxigênio através da enzima catalase. É muito importante e utilizada na indústria têxtil para remover o peróxido de hidrogênio de tecidos. Em produtos de limpeza para lentes de contato ele age como antibacteriano. Atualmente, é muito utilizado como máscaras de beleza combinado com enzimas para aumentar a oxigenação celular (cosmética), mercado muito lucrativo.
A glutationa peroxidase faz parte do sistema de defesa antioxidante enzimático celular, ela é responsável pela destoxificação de peróxidos orgânicos e inorgânicos. Sua atividade depende da glutationa reduzida que é oxidada em glutationa oxidada. A glutationa peroxidase geralmente ocorre associada ao selênio, mas pode ocorrer sem a presença do mesmo.
Sistema Não-Enzimático
O sistema de defesa não enzimático inclui, principalmente, os compostos antioxidantes através de comprimidos vitamínicos comprados em drogarias e farmácias, entre os quais se destacam: minerais (zinco,cobre,magnésio), vitaminas (A,E,C), compostos fenólicos (são estruturas químicas presente em pequenas quantidades, em alimentos de origem vegetal, que podem exercer efeitos preventivos e/ou curativos em distúrbios fisiológicos nos seres humanos).
ANTIOXIDANTES PRESENTES EM VEGETAIS E FRUTAS E PRINCIPAIS VITAMINAS
MINERAIS ANTIOXIDANTES
Selênio: Retarda o processo de envelhecimento da pele; Atua como cofator da enzima glutationa peroxidase; Indispensável para diversas funções metabólicas - Glândula tireoide e sistema imune. Vale lembrar que a deficiência de selênio é fator importante de predisposição no desenvolvimento de tumores. Entretanto, a suplementação inadequada com esse mineral antioxidante pode aumentar os processos de carcinogênese.
Zinco: Importante cofator da enzima superóxido dismutase; É cofator na absorção de vitaminas lipossolúveis; Participa da síntese de proteínas que podem se ligar a metais, como o cobre e impedir a formação de radicais livres.
Cobre: Cofator para uma série de enzimas envolvidas em reações metabólicas de integridade de DNA; Proteção antioxidante
Magnésio: Participa do metabolismo energético; A deficiência desse mineral aumenta a produção de radicais livres.
CIGARRO E ÁLCOOL
O cigarro possui mais de 4 mil compostos químicos, ele é responsável por um aumento significativo de radicais livres no corpo, isso devido as substâncias citotóxicas presentes em suas substâncias químicas. Observa-se uma redução na quantidade dos antioxidantes dos fumantes.
Quando o etanol é ingerido, parte é absorvida pelo estômago (pH 1) e outra parte no intestino delgado. A oxidação do restante do etanol é oxidado, em especial no fígado. O consumo de álcool contribui para formação de água oxigenada, devido a ingestão de álcool induzir a maior atividade de NADPH-oxidase. A oxidação do etanol se incia a partir da formação de acetaldeído, formando acetato e acetil-coA. A mudança de acetaldeído para acetato é praticamente irreversível. P acetaldeído pode interagir com aminoácidos como: cisteína (apolar, hidrofóbico, transforma-se em íon na presença de metal), lisina e serina (polares). A oxidação do acetaldeído se da pela enzima aldeídodesidrogenase. A formação de acetil-coA aumenta a ocorrência de esteatose hepática (esterificação das moléculas de acetil-coA duas a duas, gerando corpos cetônicos). Há também uma maior redução do piruvato a lactato. Em síntese, a ingestão abusiva de álcool, gera acúmulo e formação de radicais livres e queda brusca de antioxidantes do corpo, sendo extremamente prejudicial para o corpo. Além disso, a ingestão abusiva de etanol leva ao aumento significante na geração de radicais superóxidos na célula mitocondrial, favorecido pela queda da taxa de NAD+ / NADH.
Referências Bibliográficas:
[1] - BIANCHI, Maria de Lourdes Pires; ANTUNES, Lusânia Maria Greggi. Radicais livres e os principais antioxidantes da dieta. Rev. Nutr. Campinas, v.12, n.2, p. 123-130, Agosto, 1999. Disponível em: http://www.scielo.br/scielo.php?pid=S1415-52731999000200001&script=sci_arttext
[2] - BARBOSA, Kiriaque Barra Ferreira et al. Estresse oxidativo: conceito, implicações e fatores modulatórios. Rev. Nutr. Campinas, v.23, n.4, p. 629-643, agosto, 2010. Disponível em: http://www.scielo.br/scielo.php?pid=S1415-52732010000400013&script=sci_arttext
[3] - FERREIRA, A.L.A; MATSUNARA, L.S.. Radicais livres: conceitos, doenças relacionadas, sistema de defesa e estresse oxidativo. Rev. Assoc. Med. Bras., São Paulo. V.43, N.1, P. 61-68, Março. 1997. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-42301997000100014